Esta semana, la Academia sueca otorgó el premio Nobel de medicina a Katalin Karikó y Drew Weissman, por la vacuna de la covid-19 basada en ARN mensajero. Al enterarse de la tecnología que permitió crear, en tiempo récord, las vacunas más eficaces y seguras (las de Moderna y Pfizer-BioNTech) contra dicha enfermedad, uno no puede más que pensar en la circunnavegación de Magallanes y Elcano o en el viaje a la Luna de Armstrong, Collins y Aldrin, esos pequeños pasos que son un gran salto para la humanidad, esas emocionantes promesas de futuro.
El ácido ribonucleico (ARN) está conformado por un azúcar, la ribosa, un grupo fosfato y una de cuatro bases nitrogenadas: el uracilo, la adenina, la citosina o la guanina, unidades (nucleótidos) que se encadenan para formar una hebra. Hay varios tipos de ARN, cada uno con su función específica en la economía celular, pero el que acapara la atención de los científicos y está en el centro de las tecnologías terapéuticas es el mensajero (ARNm), el Hermes que copia las instrucciones para producir proteínas, cifradas en el ácido desoxirribonucleico (ADN) de los cromosomas, y lleva el mensaje desde el núcleo celular hasta los ribosomas, los organelos celulares encargados del ensamblaje.
En las vacunas tradicionales, un patógeno atenuado o inactivo es introducido al organismo, suscitando la respuesta inmunológica. La revolución de las nuevas vacunas consiste en que lo que se inyecta es tan solo la información genética necesaria para que el propio organismo produzca una proteína del patógeno, que funcione como antígeno efectivo para generar la respuesta inmune y a la vez sea un blanco idóneo para neutralizar al virus en el momento en que infecta a la persona. La vacuna es así más segura y más versátil, y también más elegante.
Si el principio es muy simple, la ingeniería bioquímica que se requiere para hacer posible el prodigio es complicadísima y su desarrollo ha tomado al menos tres décadas, sin contar el tiempo transcurrido entre la nucleína de Miescher en 1868, primer atisbo de algo que era ácido y procedía de los núcleos celulares, y el descubrimiento de la doble hélice del ADN por Watson y Crick en 1953 a partir de las imágenes por difracción de rayos X que realizó Rosalind Franklin un año antes, y de ahí a principios de la década de 1990, cuando empezaron a reportarse los primeros éxitos en producir proteínas a partir de la codificación con ARNm, en ratones.
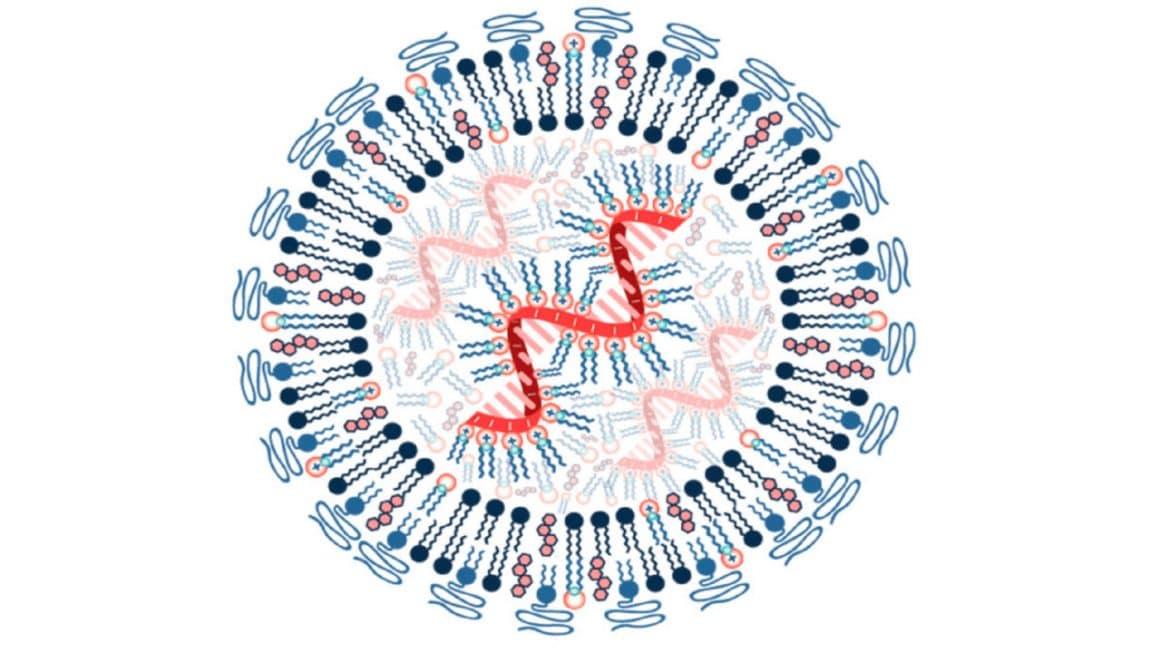
Un camino lleno de obstáculos y acertijos, una legión de científicos, grandes empresas de biotecnología. Primero hubo que enfrentar el hecho de que el ARN es altamente inflamatorio, problema grave si de lo que se trata es de inyectárselo a una persona, y la solución consistió en modificar químicamente los nucleótidos hasta encontrar la fórmula que menos inflamación producía. Un segundo problema fue que, químicamente modificado o no, el ARN mensajero que simplemente se inyecta en un organismo es del todo ineficaz, al ser inmediatamente destruido por las enzimas específicas, nucleasas, que se encuentran libres en el espacio extracelular. Una manera de proteger la delicada hebra consistió en embeberla en una nanopartícula de naturaleza lipídica, una diminuta esfera de grasa capaz de ser engullida por la célula antes de liberar su cargamento. El trabajo premiado de Karikó y Weissman fue el que hizo posible superar algunos de estos obstáculos.
Más recientemente se han probado otros vehículos para entregar el ARNm, como vesículas extracelulares y ciertos tipos celulares, cada uno con sus contras y sus pros en términos de estabilidad, eficacia o toxicidad.
Si las vacunas contra la covid-19 colocaron a la tecnología en la palestra, su desarrollo promete abarcar un campo terapéutico mucho más amplio. Por principio de cuentas, vacunas contra docenas de patógenos están en pleno desarrollo, incluyendo los cuatro serotipos del virus del dengue, la rabia, la tuberculosis, el virus de la inmunodeficiencia humana, la malaria. En el caso del virus de la influenza, que presenta mutaciones diversas cada temporada, las vacunas de ARNm ofrecen reaccionar con mucha más rapidez que las tradicionales a esas mutaciones, haciendo que los lotes anuales puedan ser más eficaces.
También se ha avanzado mucho en el diseño de vacunas contra el cáncer. El ARNm puede utilizarse para codificar proteínas que no se expresan en las células sanas pero sí en las cancerosas, que serían las atacadas por los anticuerpos resultantes. BionNTech, por ejemplo, ha identificado que en el caso del melanoma, cáncer devastador, hay cuatro de estos antígenos presentes en 90% de los enfermos y ya tiene en fase de pruebas clínicas una vacuna multivalente.
Las células cancerosas también producen mutaciones que pueden ser blanco de una vacuna. En este caso, sin embargo, el perfil de las mutaciones varía de persona a persona y por tanto el tratamiento tiene que ser individualizado. Se hace el perfil del paciente y se genera una vacuna específica para su conjunto particular de mutaciones. Lo asombroso, y esto también está en fase de pruebas clínicas, es la velocidad con la que comienza la terapia, ya que el ARNm individualizado puede estar diseñado y listo para usarse en un lapso de apenas cuatro semanas.
Los otros campos terapéuticos del ARNm están en fases más tempranas de desarrollo que las vacunas, que tuvieron un impulso monumental al comenzar la pandemia de covid-19, pero su capacidad para modificar el curso de las enfermedades da la impresión de no tener límites dado que, en principio, con esta tecnología podría producirse cualquier proteína del cuerpo: enzimas, receptores, proteínas mitocondriales, hormonas, proteínas editoras de genes y quién sabe cuántas más.
La hemofilia ofrece un buen ejemplo de cómo actúa la terapia de reemplazo de enzimas. Esta enfermedad de la sangre obedece a la falta de factores de coagulación, que son proteínas, y tradicionalmente se trata inyectando el factor VIII en el caso de la hemofilia A o el factor IX en la hemofilia B, 3 a 7 veces por semana, debido a que estas proteínas tienen una vida media de 12 horas. En estudios preclínicos realizados en ratones se ha visto que una sola inyección semanal de ARNm provoca niveles terapéuticos de esas mismas proteínas de manera sostenida y sin generar inmunidad hacia las mismas, algo que sí ocurre con los factores tradicionales, que al paso del tiempo van perdiendo eficacia.
El camino de ida es largo, al menos tanto como el de venida, y está claro que el ARNm va a acaparar el interés de la ciencia básica por muchos años. ¿Cómo manejar las dosis mucho mayores de ARNm que se necesitan para otras terapias en comparación con las dosis relativamente pequeñas que hacen efectiva a las vacunas? ¿Qué vehículo es mejor para entregar el cargamento de ARNm a las células? ¿Cómo administrar el fármaco, por inyección intramuscular, intravenosa, catéter cutáneo, aspirador nasal? ¿Cómo dar en el blanco de tejidos específicos o tumores cancerosos, sin afectar al organismo entero? ¿Qué se necesita para dar seguridad a la aplicación crónica de una terapia específica e individualizada?
Las preguntas son muchas y hay que irse con cautela, pero tampoco hay que ser aguafiestas: tenemos en el ARNm la promesa de una herramienta terapéutica con un potencial increíble, una emocionante promesa de futuro. El Nobel de este año solo lo confirma.